Las cianobacterias, o algas verdeazuladas, son el organismo que produce principalmente la microcistina en los florecimientos de algas nocivas (FAN). Todavía se está estudiando la razón por la que las cianobacterias producen toxinas, pero sin embargo, es un problema que requiere una cuidadosa consideración para gestionarlo y comprenderlo.
La importancia de la ficocianina y la clorofila-a en el monitoreo de los florecimientos de algas nocivas
La ficocianina y la clorofila-a son pigmentos que producen las algas verdeazuladas y las algas verdes. Las MPC-Buoys de LG Sonic miden estos pigmentos para determinar la presencia de algas, y ayudan a inferir si la población de algas responde a las frecuencias ultrasónicas utilizadas. Si la ficocianina y la clorofila-a aumentan, los gestores de proyectos y los científicos de LG Sonic sabrán que se necesita una frecuencia ultrasónica diferente para controlar la población de algas.

Figura 1: Dispositivo de control de algas por ultrasonidos de LG Sonic, MPC Buoy.
Dado que las cianobacterias tienen un ciclo vital corto, este tipo de algas puede adaptarse a los ultrasonidos con el tiempo. Cada población de algas contiene una genética única y siempre cambiante con cada nueva generación. Esto provoca variaciones en su resistencia a los ultrasonidos y en su capacidad para producir toxinas. Con una vida corta, estas variaciones y cambios pueden producirse rápidamente.
LG Sonic combate la resistencia a los ultrasonidos cambiando a distancia los programas de ultrasonidos y ofreciendo servicios de Control Interactivo de Algas (IAC) a medida que los datos indican una adaptación. En la actualidad, no se conocen tecnologías que puedan muestrear la microcistina de forma autónoma, por lo que se utilizan la ficocianina y la clorofila-a para evaluar la probabilidad de un florecimiento que pueda producir toxinas.
Producción de microcistina en cianobacterias
Como se ha mencionado anteriormente, las poblaciones de cianobacterias tienen una genética variable que puede permitir la producción de toxinas. A veces, el gen para producir toxinas está presente en la comunidad de algas, y a veces no. Incluso si estos genes están presentes en una población de algas, es difícil saber si se producirán toxinas. Muchos trabajos científicos afirman que las condiciones ambientales como el pH, la temperatura y los nutrientes pueden desempeñar un papel en la expresión de estos genes productores de toxinas [1].
Hay otros estudios que también han demostrado que la alta densidad de Microcystis (el género de cianobacterias que más se asocia con la producción de microcistinas) tampoco se correlaciona necesariamente con altas concentraciones de toxinas. En general, puede ser un poco impredecible. La microcistina es una molécula muy estable. Su vida media es de unas 10 semanas [2, 3]. La vida media es el tiempo que tarda la mitad de la molécula en degradarse o descomponerse. Esto significa que las toxinas producidas por un FAN pueden persistir en el medio ambiente hasta 20 semanas.
Correlación entre microcistina, ficocianina y clorofila-a
Dado que se carece de medios autónomos para medir la microcistina, conviene saber si existen parámetros medibles que se correspondan con las concentraciones de microcistina. Estudios recientes han indicado que la microcistina está positivamente correlacionada con la ficocianina y la clorofila-a [4, 5].
Esto significa que si la ficocianina y/o la clorofila aumentan, es probable que las concentraciones de microcistina también lo hagan. Desgraciadamente, es sólo una posibilidad y se basa en probabilidad. Por lo tanto, no se puede decir definitivamente que si la ficocianina o la clorofila-a están en el valor x, entonces la microcistina debe estar en el valor y.
Esto es probable, ya que la expresión génica de las algas y la producción de toxinas varían, como se ha comentado anteriormente. Sin embargo, la ficocianina y la clorofila-a pueden seguir considerándose herramientas importantes para comprender la probabilidad de producción de toxinas. Según un estudio realizado en 2016, hay una probabilidad de 50% de superar concentraciones de microcistina-LR de 0.3, 1, 1.6 y 2 μg/L cuando las concentraciones de clorofila-a son de 23.4, 67.0, 83.5 y 108.5 μg/L, respectivamente [4].
En resumen, una lectura de clorofila-a de 67.0 μg/L revela que hay un 50% de probabilidad de que la microcistina-LR sea 1 μg/L. Esto se muestra visualmente a continuación en la Figura 2.
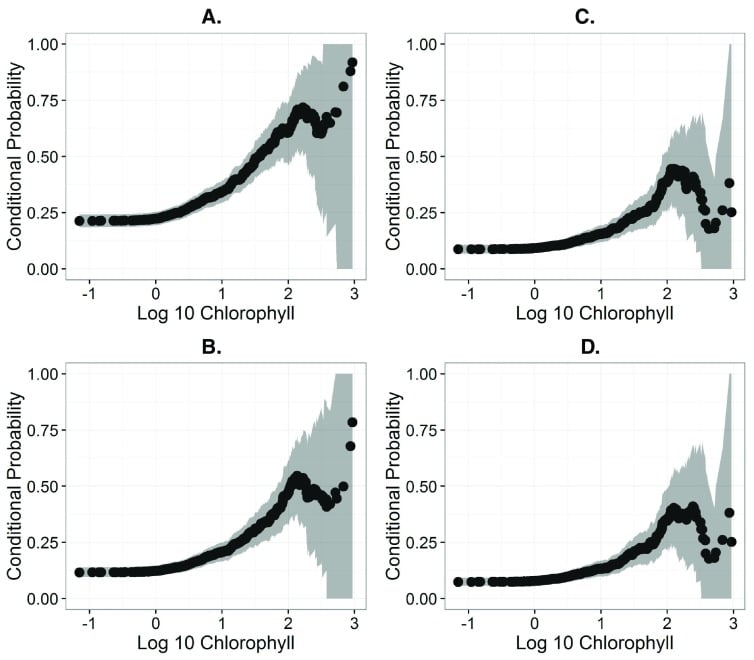
Figura 2: Diagramas de probabilidad condicional que muestran la asociación entre la probabilidad de superar varios niveles de recomendación sanitaria de microcistina-LR (MLR). A. Gráfico de la EPA EE.UU. para niños (0.3 μg/L). B. Gráfico para el consumo humano de la OMS (1 μg/L). C. Gráfico para adultos US EPA (1.6 μg/L). D. Gráfico de la OMS para uso recreativo (2 μg/L) [4].
La investigación científica moderna ha llegado a conclusiones similares en el caso de la ficocianina. Como ya se ha comentado, la ficocianina es el pigmento primario de las algas verdeazuladas o cianobacterias en los sistemas de agua dulce. Según un estudio realizado en 2024 y como se muestra en la Figura 3, la ficocianina está correlacionada de forma significativa y positiva con las concentraciones de microcistina, con un nivel de confianza del 95% [5].
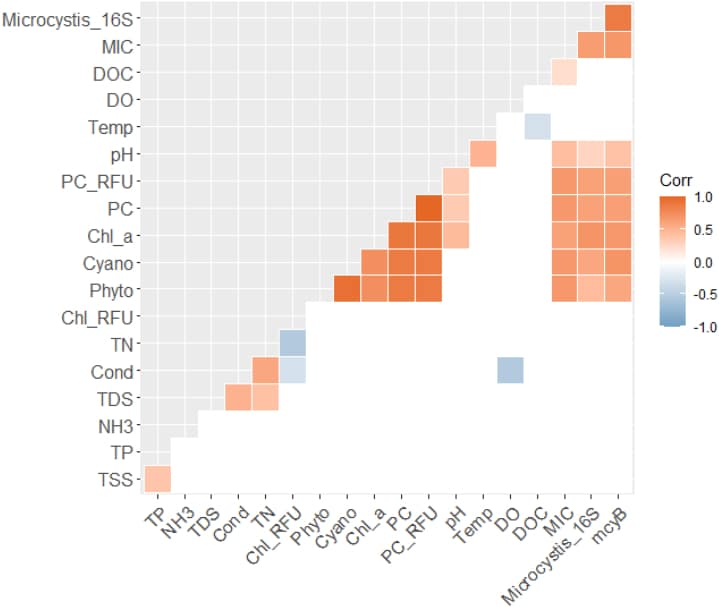
Figura 3: Correlograma que muestra los resultados de la correlación de Spearman entre 5 fuentes de agua potable. Sólo se resaltaron los parámetros que mostraban correlaciones significativas (p < 0.05). Conductividad (Cond), oxígeno disuelto (OD), pH, temperatura (Temp), sólidos suspendidos totales (SST), sólidos disueltos totales (SDT), carbono orgánico disuelto (COD), amoníaco (NH3), nitrógeno total (NT), fósforo total (PT), fluorescencia de la ficocianina (PC_RFU), fluorescencia de la clorofila (Chl_RFU), clorofila-a extraída (Chl_a), densidad celular del fitoplancton (Phyto), densidad celular de las cianobacterias (Cyano), microcistinas (MIC), gen del ARNr 16S de Microcystis (Microcystis_16S) y gen mcyB productor de microcistinas (mcyB). [5]
Sin embargo, los autores indican que se necesita más investigación para determinar cómo influyen las condiciones ambientales, el comportamiento de las algas y la profundidad en la producción de ficocianina por parte de las cianobacterias. En resumen, puede resultar más difícil establecer una comparación directa de valor por valor entre la microcistina y la ficocianina, a pesar de la fuerte correlación existente. Aunque la investigación de esta breve revisión bibliográfica no proporcionó una comparación numérica lado a lado para la microcistina y la ficocianina, muestra que la ficocianina es una herramienta importante para evaluar el crecimiento de las cianobacterias y la posible producción de microcistina.
En resumen, los diversos factores genéticos y condiciones ambientales que influyen en que las cianobacterias produzcan toxinas pueden complicar las comparaciones directas. Aún así, la ficocianina y la clorofila-a son buenos puntos de datos para medir y comparar, especialmente cuando se conoce la presencia de toxinas. Esto nos ayuda a comprender el crecimiento y los cambios en la población de algas verdeazuladas que son probablemente las responsables de la producción de microcistina.
Referencias
1. Rinta-Kanto, J., Konopko, E., DeBruyn, J., Bourbonniere, R., Boyer, G., Wilhelm, S., (2009). Microcystis del lago Erie: Relationship between microcystin production, dynamics of genotypes and environmental parameters in a large lake. Algas nocivas. 8(5): 665-673.
2. Butler, N. & Carlisle, J.C. & Linville, Regina & Washburn, Barbara. (2009). Microcystins: a brief overview of their toxicity and effects, with special reference to fish, wildlife, and livestock. Ecotoxicología de la OEHHA. 1-2.
3. Tsuji K., Watanuki T., Kondo F., Watanabe MF., Suzuki S., Nakazawa H., Suzuki M., Uchida H., Harada KI. (1995). Stability of microcystins from cyanobacteria–II. Effect of UV light on decomposition and isomerization. Toxicon. 33(12): 1619-31.
4. Hollister, J., Kreakie, B. (2016). Asociaciones entre la clorofila a y diversas concentraciones de microcistina-LR recomendadas para la salud. F1000Research. 5. 10.12688/f1000research.7955.1.
5. Hsu, T.D., Caraballo, Y.A., Wu, M. (2024). An investigation of cyanobacteria, cyanotoxins and environmental variables in selected drinking water treatment plants in New Jersey. Heliyon, 10(11).
